犀利士
犀利士仿單 犀利士Cialis完整中文說明書
犀利士® 膜衣錠 10 毫克/20 毫克
CIALIS film-coated tablets 10 mg/20 mg
犀利士膜衣錠 20 毫克 衛署藥輸字第 023774 號
犀利士膜衣錠 10 毫克 衛署藥輸字第 023809 號
製劑
膜衣錠。
10 毫克錠劑為淡黃色似杏仁形狀,在一面印有”C10”。
20 毫克錠劑為黃色似杏仁形狀,在一面印有”C20”。
臨床特性
適應症:
治療勃起功能障礙。
說明:
治療勃起功能障礙。
犀利士作用之產生,性刺激是必須的。
犀利士不應用於女性。
用法用量:
口服使用。
使用於成年男性:
一般而言,犀利士的建議劑量為 10 毫克,在預期性行為前服用,進食與否不受影響。病人服用 tadalafil 10 毫克得不到適當效果時,可嘗試 20 毫克。至少在性行為前 30 分鐘服用本藥。
服藥最多一天一次。
Tadalafil 10 毫克及 20 毫克要在預期性行為前服用,不建議持續每日用藥。
特殊族群
使用於老年男性:
老年病人不需要調整劑量。
使用於腎功能不全的男性:
輕微及中度腎功能不全的病人不需要調整劑量。嚴重腎功能不全病人的建議最大劑量為 10 毫克 。(見藥動性質欄) 。
使用於肝功能不全的男性:
犀利士的建議劑量為10毫克,在預期性行為前服用,進食與否不受影響。使用犀利士在嚴重肝功能不全(Child-Pugh Class C)病人之臨床安全性資料有限; 處方時,醫師應進行個別評估,周詳考慮對病人的利害得失。尚未有關於10毫克以上劑量之tadalafil使用在肝功能不全病人的資料(見警語和注意事項及藥動性質欄) 。
使用於糖尿病男性:
糖尿病人者不需要調整劑量。
使用於孩童及青少年:
犀利士不應使用於 18 歲以下病人。
禁忌:
對 tadalafil 或此藥的任何賦形劑過敏的病人不應使用犀利士。
臨床試驗顯示 tadalafil 會加強硝酸鹽(nitrates)的降壓效果。認為此結果是來自於硝酸鹽(nitrates)和 tadalafil 共同作用影響 nitric oxide/cGMP 代謝途徑。因此,禁止將犀利士給與正在服用任何形式之有機硝酸鹽的病人(見與其他藥物的交互作用及其他形式的交互作用欄)。
用於治療勃起功能障礙的藥物,包括犀利士,絕對不能用於不適合性行為的心臟病人。醫師應審慎評估先前患有心血管疾病的病人在從事性行為時潛在的心臟危險性。
下列心血管疾病的病人使用 tadalafil 為禁忌:
-在最近 90 天內有心肌梗塞的病人,
-有不穩定型心絞痛或曾在性交時發生心絞痛的病人,
-在最近 6 個月患有依紐約心臟協會分級為第二級或以上心臟衰竭的病人,
-病人有未受控制的心律不整、低血壓(<90/50 毫米汞柱),或未受控制的高血壓,
-最近 6 個月有中風的病人。
因非動脈性前部缺血性視神經病變(NAION)而一眼失明之病人禁止使用犀利士,無論此事件是否與先前使用 PDE5 抑制劑有關。(請見警語和注意事項欄)併用 PDE5 抑制劑 (包含 tadalafil)與鳥苷酸環化酶促進劑 (guanylate cyclase stimulators),例如riociguat,可能導致產生症狀性低血壓(請見與其他藥物的交互作用及其他形式的交互作用欄)。
警語和注意事項:
開始犀利士治療之前
在考量用藥物治療前,應先就病史及身體檢查以確實診斷勃起功能障礙還有找出致病潛因。
開始治療勃起功能障礙前,醫師應審慎評估病人的心血管狀況是否適合使用犀利士,因為性行為對心臟有某種程度的風險。Tadalafil具血管舒張性質,會造成輕度或暫時性血壓降低 (見藥效性質欄),因此會增強硝酸鹽的降壓效果(見禁忌)。病人同時服用 tadalafil 和降高血壓藥物可能會引起血壓下降。開始每天服用tadalafil 的治療時,應給予病人適當的臨床評估,可能需要調整降高血壓藥物劑量。
勃起功能障礙的評估應包括潛在根本原因的診斷和在適當醫療評估後確認適當的治療。尚未知道犀利士是否對接受骨盆手術之病人或接受切除相關神經之前列腺切除術之病人有效果。
心血管
在臨床試驗中及/或上市後有出現嚴重心血管事件,包括有心肌梗塞、突發心臟病死亡、不穩定型心絞痛、心室心律不整、中風、暫時性缺血發作、胸痛、心悸和心搏過速。觀察出現這些事件的病人其大多數先前已帶有心血管疾病危險因子。然而、無法明確判定這些不良反應是直接相關於上述危險因子、或是使用犀利士、性行為本身,或是以上因素及其他因素所合併造成。
病人服用alpha-1阻斷劑,併用犀利士可能導致某些病人出現有症狀的低血壓(見與其他藥物的交互作用及其他形式的交互作用欄)。不建議tadalafil與doxazosin併用。
視力
視覺缺損及非動脈性前部缺血性視神經病變的個案已被報導與服用犀利士及其他PDE5 抑制劑有關。觀察性數據的分析指出,患有勃起功能障礙的男性暴露在tadalafil或其他PDE5抑制劑後會增加急性NAION的風險。由於這可能和所有暴露於tadalafil的病人相關,病人應被指示若有忽然的視力障礙症狀,應停止服用犀利士並立刻就醫。(見禁忌欄)
聽力減損或突然聽力喪失
使用tadalafil的病人曾被報告出現突然聽力喪失的案例。雖然在一些案例中亦出現過其他的風險因子(如年紀、糖尿病、高血壓及先前曾有聽力喪失的病史),當病人出現突然的聽力減損或喪失時,仍建議應停止服用tadalafil並立即就醫。
肝臟功能不全
單一劑量給與犀利士在嚴重肝功能不全(Child-Pugh Class C)病人之臨床安全性資料有限; 處方犀利士時,醫師應進行個別評估,周詳考慮對病人的利害得失。
持續勃起症及陰莖構造畸形
應告知病人若持續勃起4小時或更久,應立刻尋求醫療協助。如持續勃起症沒有馬上治療,可能造成陰莖組織傷害和永久性的功能喪失。
治療勃起功能障礙的藥物、包括犀利士、使用於陰莖構造上有畸形的病人(如彎曲、海綿體纖維化或Peyronie’s病症),或病人有可能容易造成持續勃起症之情形(如鐮狀細胞貧血症、多發性骨髓瘤、或白血病) 應小心。
與CYP3A4抑制劑併用
病人使用強效 CYP3A4 抑制劑(ritonavir, saquinavir, ketoconazole, itraconazole 及erythromycin)應小心給與犀利士,併用這些藥物會增加 tadalafil 的暴露量(見與其他藥物的交互作用及其他形式的交互作用欄)。
犀利士與其他治療勃起功能障礙藥物
尚未有犀利士與其他PDE5抑制劑類藥品或其他治療勃起功能障礙藥物併用的安全性和有效性的研究。應該告訴病人不要併用犀利士和上述藥品。
乳糖
犀利士含有乳糖。病人有罕見遺傳性半乳糖不耐症,Lapp乳糖酶缺乏或葡萄糖半乳糖吸收異常不應使用此藥品。
與其他藥物的交互作用及其他形式的交互作用:
藥物交互作用的研究是以10毫克及/或20毫克 tadalafil來進行的,如下所示。對於以10毫克tadalafil來進行交互作用之臨床試驗之結果,當使用較高劑量時,無法排除其他臨床相關交互作用之可能性。
其他藥物對tadalafil的作用:
Cytochrome P450 抑制劑
Tadalafil主要是利用CYP3A4代謝。Ketoconazole是一種 CYP3A4的選擇性抑制劑 。 和 單獨給予 tadalafil 相比較 , 併 用 每 天 200 毫 克 Ketoconazole 會增加tadalafil(10 毫 克 ) 的 暴露量 (AUC)2 倍以及 Cmax 增 加 15%; 併 用 每 天 400 毫 克Ketoconazole,會增加tadalafil(20毫克)的暴露量(AUC)4倍以及Cmax增加22%。Ritonavir是一種蛋白酶抑制劑,會抑制CYP3A4, CYP2C9, CYP2C19與CYP2D6,給予200毫克每天二次,會增加tadalafil(20毫克)的暴露量(AUC)2倍而Cmax未改變。雖然尚未研究其他特定的交互作用,其他的蛋白酶抑制劑、如saquinavir,以及其他CYP3A4抑制劑,如erythromycin、clarithromycin、itraconazole及葡萄柚汁與tadalafil併用時均應小心,因為預期它們能增加血漿內tadalafil的濃度(見警語與注意事項欄)。副作用(見後面的副作用欄)的發生率可能會增加。
轉送器(Transporters)
轉送器(Transporters,例如p-glycoprotein)在tadalafil 特性表現上所扮演之角色尚未得知。因此抑制轉送器可能會有潛在的藥物交互作用。
Cytochrome P450 誘導劑
CYP3A4 的誘導劑 rifampicin 會使 tadalafil 的 AUC 降低至約只有 tadalafil 單獨給藥 AUC 值(10 毫克劑量)的 12%。可預期的是,暴露量的降低會減少 tadalafil 的藥效,其減少幅度未知。其他 CYP3A4 誘導劑例如 phenobarbital、phenytoin 及carbamazepine,可能也會降低血漿內 tadalafil 的濃度。
Tadalafil 對其他藥物的作用:
Nitrates(硝酸鹽)
臨床試驗顯示 tadalafil(5 毫克,10 毫克及 20 毫克)會加強硝酸鹽的降壓效果。因此,將犀利士給與正在服用任何形式有機硝酸鹽的病人為配伍禁忌(見禁忌欄)。根據 150 位實驗對象的臨床研究結果,每日服用 tadalafil 20 毫克 7 天以及不同時段使用 0.4 毫克舌下硝化甘油,其藥物交互作用持續超過 24 小時,而在最後一次服用 tadalafil 後 48 小時其交互作用則幾乎不可偵測。故病人服用任何劑量的犀利士時,在遇有生命危急之必要醫療情形須使用硝化物時,應至少於最後一次服用犀利士 48 小時後,再考慮使用硝化物。於這種狀況下,硝化物應只能在有周密醫療的照護下具適當血液動態監測下給與。
降血壓藥物(包含鈣離子阻斷劑)
併用doxazosin(每天4毫克或8毫克)與tadalafil(每天5毫克或單次給予20毫克)會顯著的增加此alpha阻斷劑的降血壓效果。此作用持續至少12小時,且可能出現包括暈厥在內的症狀。因此不建議併用doxazosin與tadalafil (見警語和注意事項欄)。
在人數有限的健康自願者所執行的藥物交互作用臨床試驗顯示,當併用alfuzosin與tadalafil,或併用tamsulosin與tadalafil,並無發生上述對血壓的作用。然而,當病人,尤其是老年病人,併用tadalafil與alpha阻斷劑時,應謹慎小心。此併用應以最小劑量為起始劑量,再漸進地調整劑量。
在臨床藥理研究中,評估過 tadalafil加強降壓劑降低血壓效果的潛在可能性。研究的主要幾類降壓劑,包括鈣離子通道阻斷劑(amlodipine)、血管收縮素轉化酶(ACE)抑制劑(enalapril)、beta-腎上腺素受體阻斷劑(metoprolol)、thiazide類利尿劑(bendrofluazide)、和血管收縮素II受體阻斷劑(各種種類和劑量,單獨使用或併用thiazide、鈣離子通道阻斷劑、beta-阻斷劑、和/或alpha-阻斷劑)。Tadalafil(除了與血管收縮素II受體阻斷劑及amlodipine的試驗中是以20毫克的劑量進行,其他均用10毫克)和這些種類的藥品間不具臨床意義的交互作用。在另一個tadalafil(20毫克)臨床藥理試驗中包含併用多至4類降壓劑的研究。受試者服用多種降壓劑,其行動時血壓變化與血壓受控制程度有關。血壓控制良好之受試者,其降壓改變程度輕微與健康人一般。若受試者血壓未加以良好控制,其降壓改變程度較大,然而在大多數的受試者中,此降壓現象與觀察到的低血壓症狀無關。病人同時服用降壓劑,tadalafil 20毫克可能引起血壓降低(alpha阻斷劑除外,見上面說明),其反應通常是輕微,且不具臨床相關性。分析第三期的臨床試驗數據顯示,服用tadalafil 的病人不論有無併用降壓劑,其副作用沒有差異。然而,仍應適度告知病人當接受降血壓藥物治療時可能引起的血壓降低。
Riociguat
臨床前試驗顯示PDE5抑制劑與riociguat併用時,會出現額外的系統性血壓降低作用。臨床試驗中,riociguat會增強PDE5抑制劑的低血壓作用。在受試族群中沒有證據顯示併用會產生有利的臨床效果。併用riociguat與PDE5抑制劑(包含tadalafil)為禁忌(請見禁忌欄)。
5-α reductase inhibitor (5-ARIs)
一個臨床試驗中,比較同時給予tadalafil 5毫克、finasteride 5毫克及同時給予安慰劑、finasteride 5毫克對於良性攝護腺肥大症狀的改善,並未發現新的不良反應。然而,尚未正式執行能評估tadalafil及5-ARIs的藥物交互作用試驗,當併用tadalafil及5-ARIs時,應特別留意。
CYP1A2受質(如: theophylline )
在臨床藥理研究中,當tadalafil 10毫克與theophylline(為一非選擇性磷酸雙水解酶抑制劑)併用時無藥動交互作用。僅有的藥效學影響是小幅(3.5 bpm)增加心跳速率。雖然在此一研究中顯示此一交互作用可能影響輕微也無臨床上顯著的意義,但合併使用這些藥物時仍須審慎考量此一可能之交互作用。
Ethinylestradiol及terbutaline
Tadalafil證實能增加ethinylestradiol口服生體可用率; 預期對口服terbutaline也會有相似增加情形,雖然尚未確定其臨床結果。
酒精
酒精濃度(平均最大血中濃度0.08%)不會受併用tadalafil (10毫克或20毫克)的影響。另外,併用酒精3小時後,tadalafil的濃度未見改變。酒精給與的方式是以最大吸收率時給與(空腹隔夜未進食直到飲酒後2小時)。Tadalafil (20毫克)不會增強酒精(0.7公克/公斤或大約180毫升40%酒精的伏特加於80公斤男性身上)引發平均血壓降低的作用,可是某些受試者有觀察到姿勢性頭暈現象及姿勢性低血壓。當tadalafil與較低量的酒精(0.6公克/公斤)併用,則未觀察到低血壓而頭暈現象則與單獨飲酒的頻率一般。Tadalafil (10毫克) 不會增強酒精對認知功能的作用。
Cytochrome P450代謝的藥物
Tadalafil預期不會對經由CYP450同質異構物代謝之藥物的清除率,造成臨床上有意義的抑制或誘導作用。研究已確認tadalafil不會抑制或誘導CYP450同質異構物,包括CYP3A4、CYP1A2、CYP2D6、CYP2E1、CYP2C9和CYP2C19。
CYP2C9 受質(如: R-warfarin)
Tadalafil(10 毫克及 20 毫克)對 S-warfarin 或 R-warfarin (CYP2C9 受質)的暴露量(AUC)無臨床上顯著的影響,且 tadalafil 對由 warfarin 造成之凝血原時間改變也沒有影響。
Aspirin (乙醯水楊酸)
Tadalafil(10毫克及20毫克)不會延長由乙醯水楊酸引起之出血時間。
糖尿病藥物
尚未研究與糖尿病藥物間的交互作用。
懷孕和授乳:
犀利士不應用於女性。
懷孕
目前並無tadalafil用於孕婦的臨床數據。動物試驗未直接或間接顯示對懷孕、胚胎/胎兒生長、分娩或產後發展上有損害結果 (見臨床前安全性資料欄) 。在懷孕期間不應使用犀利士。
授乳
動物的藥效及毒理資料顯示 tadalafil 會藉由乳汁分泌,不能排除其對授乳孩童可能造成的風險,在授乳期間不應使用犀利士。
生殖力
曾發現可能降低小狗的生殖力。兩個後續臨床試驗顯示人類不大可能發生這類影響,雖然曾經在某些男性身上觀察到精子濃度下降的情況 (見藥效性質及臨床前安全性資料欄)。
對駕駛和操作儀器能力的影響:
尚無犀利士影響駕駛和操作儀器能力的臨床試驗。即使在臨床試驗中,其安慰劑組和 tadalafil 組的暈眩報告頻率相似,病人在駕駛和操作儀器前,仍應意識到其本身對犀利士的可能相關反應。
副作用:
安全性資料摘要
服用犀利士治療勃起功能障礙及良性攝護腺肥大症的病人,最常見的不良反應報告為頭痛、消化不良、背痛及肌肉痛,不良反應發生率會隨著犀利士劑量增加而增加。不良反應報告為暫時性,一般而言為輕微或中度的。服用犀利士一天一次的病人,大多數的頭痛報告是發生在開始接受治療的第10到30天內。
不良反應列表摘要
下表所列為自主性通報和安慰劑對照、勃起功能障礙臨床試驗發生的不良反應(共包含8022位服用犀利士的病人和4422位服用安慰劑的病人),試驗病人包含當需要時及每日一次治療勃起功能障礙和每日一次治療良性攝護腺肥大症。頻率評估:很常見(≥1/10),常見(≥1/100至<1/10),不常見(≥1/1000至<1/100),罕見(≥1/10000至<1/1000),非常罕見(<1/10000)和未知(無法由目前的資料來預估其發生率)。
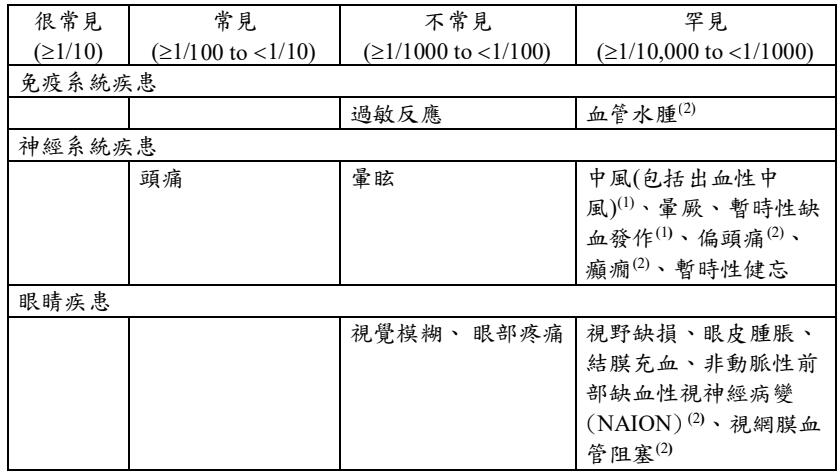
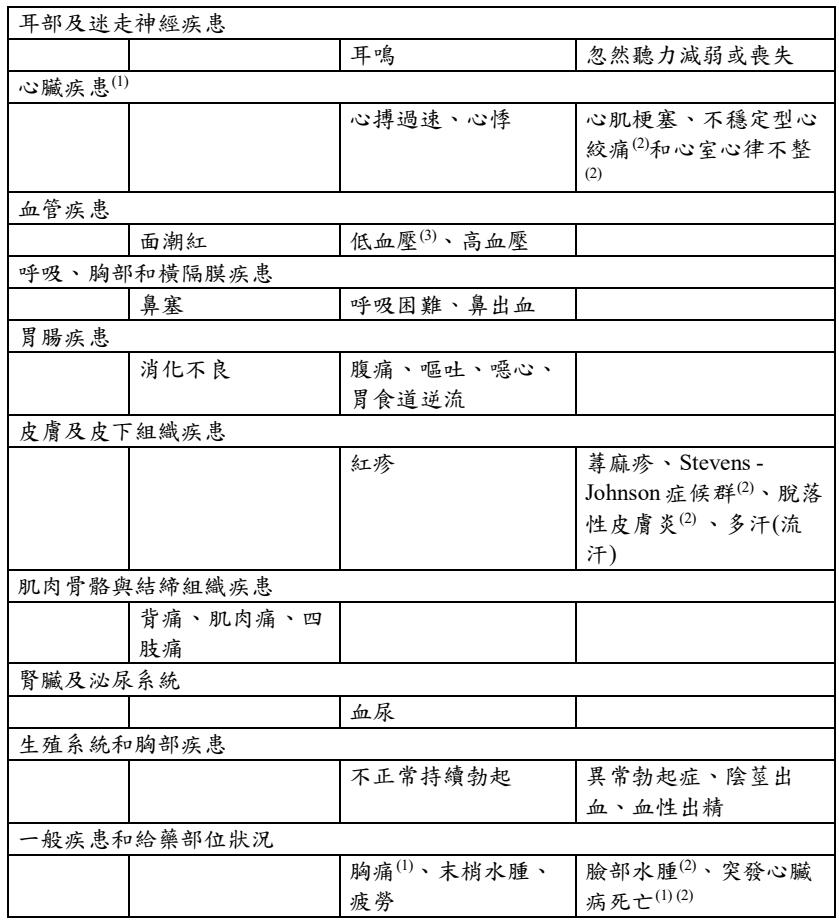
(1) 有此不良反應的大部分病人皆早已存在心血管方面的危險因子。(見警語和注意事項欄)
(2) 上市後自發性通報的不良反應,這些不良反應並未於安慰劑對照的臨床試驗中發現。
(3) 較常發生在已經服用降血壓藥物並給予 tadalafil 的病人。
選出的不良反應之描述
與安慰劑相較,服用tadalafil一天一次的病人有心電圖異常(主要為竇性心搏徐緩)報告的比例稍高。大部份的心電圖異常與不良反應無關。
其他特殊族群
服用犀利士治療勃起功能障礙或良性攝護腺肥大症的臨床試驗中,65歲以上的病人資料有限。在需要時使用犀利士治療勃起功能障礙的臨床試驗中,65歲以上的病人較常有腹瀉的不良反應報告。在服用犀利士5毫克一天一次來治療良性攝護腺肥大症的臨床試驗中,75歲以上病人較常有暈眩和腹瀉的不良反應報告。
過量:
曾給過健康受試者最高至500毫克的單一劑量,也曾給過病人每天多次劑量最高至100毫克。副作用與較低劑量所見相似。萬一過量,必須採用標準支持性療法。血液透析對tadalafil的清除沒有幫助。
藥理性質
藥效性質
藥理分類:泌尿道,用於勃起功能障礙的藥物(ATC 編碼: G04BE08)。
作用機轉:
Tadalafil 是一個具選擇性、可逆的環狀單磷鳥糞核糖苷 (cyclic guanosine monophosphate, cGMP)-特定的磷酸雙水解酶第五型(phosphodiesterase type 5,PDE5)的抑制劑。當性刺激造成一氧化氮(nitric oxide)局部釋出時,tadalafil抑制PDE5的作用造成海綿體內cGMP的濃度增加,導致平滑肌放鬆和血流流入陰莖而勃起。若無性刺激,則tadalafil沒有作用。
藥效性質:
體外研究顯示tadalafil是PDE5的選擇性抑制劑。PDE5是一種酵素,可在海綿體的平滑肌、血管和內臟平滑肌、骨骼肌、血小板、腎臟、肺、和小腦中發現。Tadalafil對PDE5的作用比其他磷酸雙水解酶強。Tadalafil對PDE5的作用比在心臟、腦部、血管、肝臟、和其他器官發現的PDE1、PDE2和PDE4酵素強10000倍以上。Tadalafil對PDE5的作用比在心臟和血管發現的PDE3酵素強10000倍以上。對PDE5的選擇性比PDE3來的大是重要的,因為PDE3酵素會影響心臟的收縮力。另外,tadalafil對PDE5的作用比在視網膜出現和負責光轉移的PDE6酵素強約700倍。Tadalafil對PDE5的作用也比PDE7 – PDE10強10000倍以上。
臨床療效與安全性:
有三個臨床試驗進行,1054位病人在家評估對需要時服用犀利士的反應期。犀利士顯現在勃起功能的改善上具統計學意義且病人在服藥後最久至36小時,仍具有成功性交的能力,另外,相較於安慰劑,病人在服藥後最早16分鐘,已具有達到且維持勃起的能力以成功性交。
給與健康受試者tadalafil,在仰臥時的收縮壓和舒張壓(平均最大降壓分別為1.6/0.8毫米汞柱)、站立時收縮壓和舒張壓(平均最大降壓分別為0.2/4.6毫米汞柱),相較於安慰劑並無明顯的差異,且心跳速率沒有明顯的改變。在一研究中評估 tadalafil 對視覺的影響,使用 Farnsworth-Munsell 100 顏色測試,沒有偵測到對顏色辨識能力(藍色/綠色)的損害。此發現與 tadalafil 對 PDE6比對 PDE5 有較低親和力的現象一致。在所有的臨床試驗中,罕有彩色視覺改變的報告(< 0.1%)。
有三個試驗評估每天服用犀利士10毫克 (6個月試驗)及20毫克 (6個月試驗與9個月試驗)對男性精子生成可能的影響。在二個試驗中顯示精子數量與濃度減少和使用犀利士有關,但不太可能有臨床上的意義。上述反應與其他因子,例如活動力、型態和促濾泡成熟激素(FSH)的改變是沒有關連的。
在包括3250位病人的16個臨床試驗中,評估tadalafil於2-100毫克劑量時的作用,其中病人包括各種程度(輕度、中度、嚴重)的勃起功能障礙、病因學、年齡(21-86歲)、和種族。大部分病人的勃起功能障礙至少1年。在一般族群的主要療效研究中,81%病人報告犀利士改善他們的勃起狀況,相較安慰劑為35%。同時,犀利士也改善各種不同程度勃起功能障礙病人的勃起狀況(輕度、中度和嚴重分別為86%、83%和72%,相較安慰劑為45%、42%和19%)。在主要療效研究中,75%以犀利士治療的病人嘗試進行性交成功,相較安慰劑為32%。
在一個12週、186位勃起功能障礙繼發脊髓損傷的病人(犀利士組142位,安慰劑組44位)的試驗中,犀利士顯著的改善勃起功能障礙,接受10毫克或20毫克犀利士(劑量依病人需求調整)的受試者其嘗試成功的平均比率為48%,安慰劑組為17%。
孩童及青少年:
相關資訊請見用法用量欄使用於孩童及青少年。
藥動性質
吸收:
Tadalafil 口服後迅速被吸收且在給藥後 2 小時(中位數時間)到達可觀察的平均最大血漿濃度(Cmax)。尚未確定 tadalafil 口服後的絕對生體可用率。
Tadalafil的吸收速率和程度不受食物影響,因此,犀利士可與食物或不與食物併用。給藥時間(早晨或晚上)對吸收速率和程度沒有臨床上相關的影響。
分佈:
Tadalafil 的平均分佈體積約為 63 公升,顯示其分佈於組織中。在治療濃度下,血漿中 94%的 tadalafil 與蛋白質結合。蛋白質的結合不受腎功能損傷之影響。在健康受試者的精液中,顯現的量少於投與劑量的0.0005%。
生體轉換:
Tadalafil主要藉由細胞色素P450 (CYP) 3A4同質異構物代謝,主要的循環代謝物是methylcatechol glucuronide。此代謝物對PDE5的效力比tadalafil小至少13000倍。因此,在可測代謝物的濃度下,不預期它有臨床活性。
排除:
在健康受試者中,tadalafil的平均口服清除率為2.5公升/小時,且平均半衰期為17.5小時。Tadalafil主要以非活性代謝物排泄,大部份在糞便中(約劑量的61%)和較少量於尿液中(約劑量的36%)。
線性/非線性:
在健康受試者中,tadalafil 相對於時間和劑量的藥動表現呈線性。在 2.5 毫克至20 毫克間,暴露量(AUC)與劑量成比例的增加。每天給藥一次,在 5 天內血漿濃度可達穩定狀態。
以群體藥動方法分析的結果顯示(population PK)有勃起功能障礙的病人和沒有勃起功能障礙的受試者其藥動性質相似。
特殊族群:
老年人
與19-45歲的健康受試者相比較,健康老年受試者(65歲以上),有較低的tadalafil口服清除率,導致其暴露量(AUC)高出25%。年齡的影響不具臨床意義,因此無法證明劑量需要調整。
腎功能不全
臨床藥理研究中,有輕度(肌酸酐清除率 51-80 毫升/分鐘)或中度(肌酸酐清除率31-50 毫升/分鐘)腎功能不全的受試者以及接受透析的末期腎衰竭受試者,在服用單一劑量 tadalafil(5-20 毫克)後,其 tadalafil 暴露量(AUC)約高二倍。血液透析的受試者其 Cmax較健康受試者高 41 %。
血液透析對tadalafil的清除沒有幫助。
肝功能不全
輕度和中度肝功能不全(Child-Pugh Class A和B)的受試者服用10毫克劑量後,其tadalafil暴露量(AUC)與健康受試者相似。使用犀利士在嚴重肝功能不全(ChildPugh Class C)病人之臨床安全性資料有限; 處方時,醫師應進行個別評估,周詳考慮對病人的利害得失。尚未有關於10毫克以上劑量之tadalafil使用在肝功能不全的病人的資料。
糖尿病病人
糖尿病病人的tadalafil暴露量(AUC) 值約比健康受試者低19%。並不需要因此暴露量的差異而調整劑量。
臨床前安全性資料:
基於傳統的安全性藥理學、反覆劑量毒性、基因毒性、致癌可能性、生殖毒性的研究,臨床前數據顯示對人體無特別的危險性。在給與最高劑量至1000毫克/公斤/天的大白鼠和小白鼠上,沒有發現致畸胎性、胚胎毒性或胎兒毒性的證據。大白鼠的胎兒出生前和出生後的發展研究中,30毫克/公斤/天的劑量不具有可觀察到之影響。懷孕的大白鼠在此劑量下經計算的原型藥物的AUC約為人類在20毫克劑量下AUC的18倍。
對公和母大白鼠的繁殖力沒有傷害。給與狗每天tadalafil 25毫克/公斤/天或更高劑量(造成暴露量至少為人類單一劑量20毫克的3倍暴露量[範圍3.7-18.6]) 6至12個月,某些狗會有細精管上皮細胞退化的情形以致於造精能力降低。見警語和注意事項和藥效性質欄。
賦形劑
錠劑核心:
lactose monohydrate, croscarmellose sodium, hydroxypropyl cellulose, microcrystalline cellulose, sodium laurilsulfate, magnesium stearate
膜衣層:
lactose monohydrate, hypromellose, triacetin, titanium dioxide (E171), iron oxide yellow (E172), talc
儲存時注意事項
保存於原包裝中。儲存條件 30℃以下。
包裝
2-1000 錠鋁箔盒裝
本藥須由醫師處方使用
註冊商標係由美商美國禮來大藥廠授權使用
製造廠: Lilly Del Caribe Inc.12.6 KM 65th Infantry Road, Carolina 00985, Puerto Rico
包裝廠: Lilly S.A.Avda. de la Industria 30, 28108 Alcobendas, Madrid, Spain
藥 商:台灣禮來股份有限公司
台北市復興北路 365 號 11 樓
Warning: Trying to access array offset on value of type bool in /var/www/fastuser/data/www/zihesp.com/wp-content/themes/flatsome/inc/shortcodes/share_follow.php on line 29
